臨床試驗造假�,又一醫(yī)械產(chǎn)品被揪出!
發(fā)布時間:[2016-10-28 10:21 ] 查看次數(shù):
還記得國家藥監(jiān)總局在今年7月展開的2016年第一批醫(yī)療器械臨床試驗監(jiān)督抽查嗎�?
9月份,總局曾發(fā)布監(jiān)督抽查情況公告���,有4家企業(yè)的4個注冊申請項目,被查出存在臨床試驗真實性問題����。
然而,藥監(jiān)總局較新公告顯示���,在第一批醫(yī)療器械臨床試驗監(jiān)督抽查中���,還有1家企業(yè)的醫(yī)械產(chǎn)品也被查出造假�。
10月26日�,藥監(jiān)總局發(fā)布《關(guān)于1個醫(yī)療器械注冊申請項目臨床試驗監(jiān)督抽查有關(guān)情況的公告(2016年第170號)》。2016年7月��,德國Abbott GmbH & Co. KG申請的人類T淋巴細(xì)胞病毒Ⅰ/Ⅱ型抗體檢測試劑盒(化學(xué)發(fā)光微粒子免疫檢測法)(受理號:進(jìn) 15-1668)���,被檢查發(fā)現(xiàn)�,在解放軍第一七四醫(yī)院開展的臨床試驗存在真實性問題����。
具體來說,部分臨床試驗用樣本重復(fù)使用:有2例陽性試驗樣本(ID 174-013�����、ID 174-229)為使用同一患者(病例號1680323)在2014年10月15日采集的樣本���;有12例陽性試驗樣本為6個患者(病例號438587���、1437909、1995398��、2040095�����、1963540、1899710)分別在不同日期采集2次的樣本��;有2例陰性試驗樣本(ID 174-123�����、ID 174-124)為使用同一患者(病例號1958017)采集的樣本���。
對上述臨床試驗造假問題���,總局決定對該企業(yè)的該注冊申請項目不予注冊,并自不予注冊之日起一年內(nèi)不予再次受理����。此外��,對涉嫌出具虛假報告的解放軍第一七四醫(yī)院及相關(guān)責(zé)任人���,責(zé)成福建省藥監(jiān)局按照《醫(yī)療器械監(jiān)督管理條例》規(guī)定調(diào)查處理��。
由此����,在第一批10個監(jiān)督抽查項目中,恰好一半�����,也就是5家企業(yè)的5個注冊申請項目不幸“陣亡”了���,其中國產(chǎn)2個�����、進(jìn)口3個�。
第二批監(jiān)督抽查�,10個項目已抽出
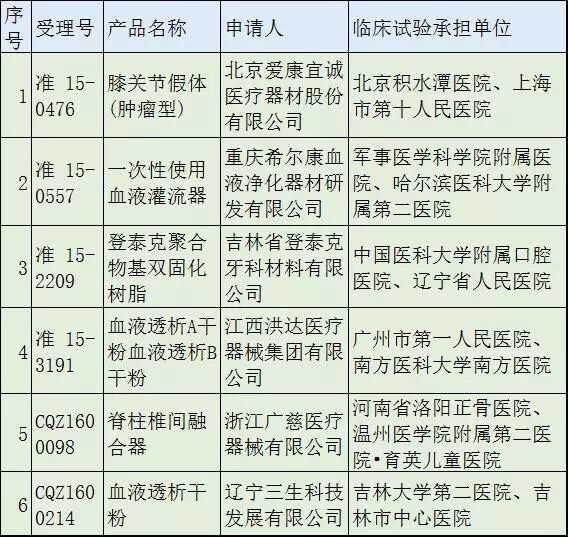
同一天(10月26日),總局還發(fā)布了關(guān)于《2016年第二批醫(yī)療器械臨床試驗監(jiān)督抽查項目》的公告����,決定對膝關(guān)節(jié)假體(腫瘤型)(受理號:準(zhǔn) 15-0476)等10個注冊申請項目,展開臨床試驗數(shù)據(jù)的真實性和合規(guī)性實施回顧性監(jiān)督檢查��。
這10個待查項目分別是:
與第一批國產(chǎn)����、進(jìn)口各半不同���,第二批國產(chǎn)占了絕大多數(shù)。具體檢查時間將由總局食品藥品審核查驗中心另行通知��。
從第一批10個注冊申請項目的檢查結(jié)果來看��,“陣亡率”50%很不樂觀��。第二批會依然難逃厄運(yùn)����?或是反而形勢大好呢?
一切靜待檢查結(jié)果出爐�����!
【聲明】本文為轉(zhuǎn)載��,管理員不對其準(zhǔn)確性及觀點(diǎn)負(fù)責(zé)��。如涉及版權(quán)問題請留言��,我們將立即處理����,以保障雙方權(quán)益,謝謝����。